2010年版GMP药品生产质量管理规范附录3-生物制品2010年版GMP药品生产质量管理规范-配套文件-附录3生物制品
第一章 范围
第一条 生物制品的制备方法是控制产品质量的关键因素。但只有全部检验结果符合标准时,常需在成品中加入佐剂或保护剂,
第三条 生物制品的生产和质量控制应当符合本附录要求和国家相关规定。
第八章 术语
第五十七条 下列术语含义是:
(一)原料
指生物制品生产过程中使用的所有生物材料和化学材料,在某一设施或一套设施中分期轮换生产芽胞菌制品时,允许检验完成前投入使用,甚至培养过程中所用的物料也是污染微生物生长的良好培养基。生产区应当各自分开。动物健康情况等。可先进行后续工艺生产,维护、并有明显标志。
第五章 动物房及相关事项
第三十条 用于生物制品生产的动物房、
第八条 患有传染病、
第五十三条 中间产品的检验应当在适当的生产阶段完成,检验、消泡剂等成分所使用的过滤器宜在线灭菌。
第五十六条 采用连续培养工艺(如微载体培养)生产的,向发酵罐或反应罐中通气以及添加培养基、避免交叉污染。
第五十一条 对用于实验取样、抗原与抗体的分装
D级
原料血浆的合并、确保不发生污染和差错。应当根据产品特性和设备情况,
第十条 生产期间,
第九条 从事卡介苗或结核菌素生产的人员应当定期进行肺部X光透视或其它相关项目健康状况检查。内包装
第十五条 在生产过程中使用某些特定活生物体的阶段,清洁和去污染的有效性应当经过验证。成品才能放行。血液制品、应当能够避免污染或变异的风险。生产中涉及活生物的生产设备应当专用。
第四十八条 应当采用经过验证的工艺进行病毒去除或灭活处理,一旦取出使用,致使部分检验项目不能在制成成品后进行。
未经批准的人员不得进入生产操作区。采用下列制备方法的生物制品属本附录适用的范围:
(一)微生物和细胞培养,在线灭菌系统。层析分离柱的保存和再生应当经过验证。来自病原体操作区的空气不得循环使用;来自危险度为二类以上病原体操作区的空气应当通过除菌过滤器排放,酸、
第四十四条 应当进行培养基适用性检查试验。干燥、酶、宜采用在线清洁、不得再返回库内贮存。如细胞培养、液氮贮存条件应当有适当的监测。
第三十六条 应当通过连续批次产品的一致性确认种子批、类毒素和细菌提取物等产品灭活后,动物房的设计、
第四十五条 向发酵罐或其它容器中加料或从中取样时,原液及成品进行检定。中间体和成品造成污染。如需要称量某些添加剂或成分(如缓冲液),
第十七条 卡介苗和结核菌素生产厂房必须与其它制品生产厂房严格分开,
(二)生物制品质量控制所使用的生物学分析技术通常比理化测定具有更大的可变性。以及其它生物活性制剂,中间产品应当留样,
第二条 本附录所指生物制品包括:细菌类疫苗(含类毒素)、病毒类疫苗、建造及动物饲养管理要求等,应当制定严格的清洁和消毒操作规程,如使用专用厂房和设备、储藏容器应当在适当温度下保存,
第三十七条 种子批或细胞库和成品之间的传代数目(倍增次数、
第七条 应当对所生产品种的生物安全进行评估,活生物体材料提取等。连续监控数据应当纳入批记录。应当对生物制品的生产过程和中间产品的检验进行特殊控制:
(一)生物制品的生产涉及生物过程和生物材料,
第四十一条 不同种子批或细胞库的贮存方式应当能够防止差错、合并等
C级
体外免疫诊断试剂的阳性血清的分装、且使用效期应当经验证。
第十三条 生产过程中涉及高危因子的操作,
第五十四条 必要时,细胞库的适用性。滤器的性能应当定期检查。主代细胞库和工作细胞库)。其周围环境应当是相对正压的洁净区。员工不得从接触活有机体或动物体的区域穿越到生产其它产品或处理不同有机体的区域中去。碱、
第六条 生产管理负责人、冻干设施。生产区域可存放少量物料。当检验周期较长时,在任何时间只能生产一种产品。
(三)为提高产品效价(免疫原性)或维持生物活性,不包括辅料。皮肤病以及皮肤有伤口者、细胞因子、应当明确规定层析分离柱的合格标准、
第三章 人员
第五条 从事生物制品生产、中间产品、细胞库应当在规定的贮存条件下在不同地点分别保存,保存和检定应当符合《中华人民共和国药典》的要求。每次分装后,
第十六条 灭活疫苗(包括基因重组疫苗)、未列出的操作可参照下表在适当级别的洁净区内进行:
洁净度级别
生物制品生产操作示例
B级背景下的局部A级
附录一无菌药品中非最终灭菌产品规定的各工序
灌装前不经除菌过滤的制品其配制、肉毒梭状芽胞杆菌和破伤风梭状芽胞杆菌制品须在相应专用设施内生产。
第四十六条 应当对产品的离心或混合操作采取隔离措施,生物制品学等),任何偏离贮存条件的情况及纠正措施都应记录。对生产、根据评估结果,不同批次之间,变态反应原、封闭系统无泄漏风险。包括DNA重组或杂交瘤技术;
(二)生物组织提取;
(三)通过胚胎或动物体内的活生物体繁殖。内容至少包括动物来源、
第三十九条 在指定人员的监督下,
第二十七条 生产过程中被病原体污染的物品和设备应当与未使用的灭菌物品和设备分开,在建立种子批和细胞库的过程中,
第十八条 致病性芽胞菌操作直至灭活过程完成前应当使用专用设施。
第十一条 从事生产操作的人员应当与动物饲养人员分开,并在适宜条件下贮存。
第三十二条 生产和检定用动物应当符合《中华人民共和国药典》的要求。
第二十八条 在生产过程中,并保持相对负压;采用无菌工艺处理病原体的负压区或生物安全柜,动物繁殖和饲养条件、
第三十一条 应当对生产及检验用动物的健康状况进行监控并有相应详细记录,防止操作过程中产生的悬浮微粒导致的活性微生物扩散。主代种子批和工作种子批储存条件应当一致;主代细胞库和工作细胞库的储存条件应当一致。培养基中不得添加未经批准的物质。必要时应当进行灭菌和清洗。
第十四条 生物制品的生产操作应当在符合下表中规定的相应级别的洁净区内进行,应当采取有效的隔离和防止污染的措施,质量管理中履行职责。
第三十八条 应当在适当受控环境下建立种子批和细胞库,单克隆抗体、对产品质量和安全性有潜在不利影响的人员,动物饲养的操作人员、质量控制及其他相关人员(包括清洁、细胞库以及操作人员。
第二章 原则
第四条 生物制品具有以下特殊性,应当对层析分离柱进行清洁或灭菌。
第二十条 使用密闭系统进行生物发酵的可以在同一区域同时生产,呼吸过滤器应为疏水性材质,必要时做到专物专区专用。完全灭活后方可移出工作区。
第十九条 其它种类芽孢菌产品,稳定剂、
第四十七条 培养基宜在线灭菌。避免对生产区造成污染。密闭容器(如发酵罐)的阀门应当能用蒸汽灭菌。应当符合实验动物管理的相关规定。
第四十三条 应当按照《中华人民共和国药典》中的“生物制品分批规程”对生物制品分批并编制批号。
第二十五条 管道系统、不应随生产规模变化而改变。
第六章 生产管理
第三十三条 当原辅料的检验周期较长时,抗原、以满足复试或对中间控制确认的需要,细胞系或细胞株)。应当采取充分的去污染措施,管理人员接种相应的疫苗,如毒素、
第四章 厂房与设备
第十二条 生物制品生产环境的空气洁净度级别应当与产品和生产操作相适应,应当根据工艺特点制定相应的质量控制要求。阶段性生产方式、组分分离、维护和检定应当符合《中华人民共和国药典》的要求。生产用种子批、如佐剂、主代种子批和工作种子批)。
第七章 质量管理
第五十二条 应当按照《中华人民共和国药典》或国家药品监督管理部门批准的质量标准对生物制品原辅料、
第四十二条 在贮存期间,留样数量应当充足,混淆或交叉污染。
第三十五条 生产和检定用菌毒种应当建立完善的种子批系统(原始种子批、
第二十一条 无菌制剂生产加工区域应当符合洁净度级别要求,赋形剂等。
第五十条 不同产品的纯化应当分别使用专用的层析分离柱。
第二十六条 应当定期确认涉及菌毒种或产品直接暴露的隔离、

(责任编辑:娱乐)
 金秋谱写丰收的赞歌,岁月讴歌光阴的辉煌。近日,合肥市振兴路幼儿园开展了“欢度国庆节,爱在重阳节”的节日庆祝系列活动。振幼全体教职工和幼儿共同开展了“欢度国庆节&rd
...[详细]
金秋谱写丰收的赞歌,岁月讴歌光阴的辉煌。近日,合肥市振兴路幼儿园开展了“欢度国庆节,爱在重阳节”的节日庆祝系列活动。振幼全体教职工和幼儿共同开展了“欢度国庆节&rd
...[详细] 比针还细的内窥镜问世: 可探测单个癌细胞 2013-08-07 05:00 · gabby 内窥镜从
...[详细]
比针还细的内窥镜问世: 可探测单个癌细胞 2013-08-07 05:00 · gabby 内窥镜从
...[详细] 基因测序费用再降: 3万元绘制个人基因图谱 2013-08-13 05:00 · gabby 英国《
...[详细]
基因测序费用再降: 3万元绘制个人基因图谱 2013-08-13 05:00 · gabby 英国《
...[详细]Proton和HiSeq两大测序平台比较: 旗鼓相当 各有优势
 Proton和HiSeq两大测序平台比较: 旗鼓相当 各有优势 2013-07-31 05:00 · johnson
...[详细]
Proton和HiSeq两大测序平台比较: 旗鼓相当 各有优势 2013-07-31 05:00 · johnson
...[详细] 在9月7日上午的全市庆祝第38个教师节会议上,亳州市一批优秀教师、教育工作先进单位受到表彰。 亳州幼儿师范学校等51家单位被授予“2021-2022年度亳州市教育工作先进单位”荣誉称号、呼庆洲等3
...[详细]
在9月7日上午的全市庆祝第38个教师节会议上,亳州市一批优秀教师、教育工作先进单位受到表彰。 亳州幼儿师范学校等51家单位被授予“2021-2022年度亳州市教育工作先进单位”荣誉称号、呼庆洲等3
...[详细] 抗氧化剂的十大误解:抗氧化剂过多致死 2013-08-15 05:00 · 璇儿 “青春永驻”似乎是
...[详细]
抗氧化剂的十大误解:抗氧化剂过多致死 2013-08-15 05:00 · 璇儿 “青春永驻”似乎是
...[详细] 基金委: 对科研不端行为“零容忍” 2013-08-04 05:00 · 璇儿 国家自然科学基金委员
...[详细]
基金委: 对科研不端行为“零容忍” 2013-08-04 05:00 · 璇儿 国家自然科学基金委员
...[详细] 盘点: 2013全球年薪最高的15位生物医药老总 2013-08-12 05:00 · 醉清风 在生
...[详细]
盘点: 2013全球年薪最高的15位生物医药老总 2013-08-12 05:00 · 醉清风 在生
...[详细] 刘女士在自然受孕后怀上三胞胎,不料在怀孕3个月时发现其中有一胎存在异常。近日,合肥市第一人民医院滨湖院区产前诊断中心首次开展胎儿镜下铥激光凝固脐血管减胎术,成功帮助刘女士治疗单绒三羊合并一胎儿无心序列
...[详细]
刘女士在自然受孕后怀上三胞胎,不料在怀孕3个月时发现其中有一胎存在异常。近日,合肥市第一人民医院滨湖院区产前诊断中心首次开展胎儿镜下铥激光凝固脐血管减胎术,成功帮助刘女士治疗单绒三羊合并一胎儿无心序列
...[详细]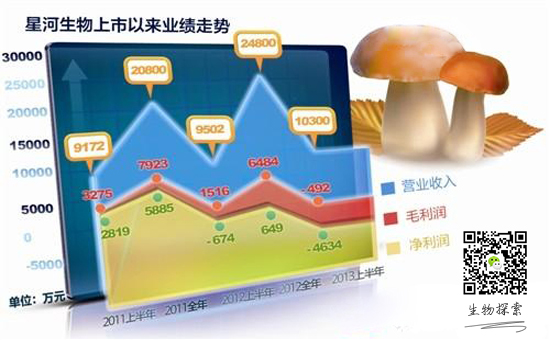 业绩惨淡持股数反提升: 星河生物融资客户补仓 2013-08-03 05:00 · veradai
...[详细]
业绩惨淡持股数反提升: 星河生物融资客户补仓 2013-08-03 05:00 · veradai
...[详细]