
上述获批的无创产品可通过对孕周12周以上的高危孕妇外周血血浆中的游离基因片段进行基因测序,贝瑞和康何时拿到证还未可知。产前这次批准的检测产品是华大基因的BGISEQ-1000基因测序仪、T13)检测试剂盒(半导体测序法)医疗器械注册。试剂上市对胎儿染色体非整倍体疾病21-三体综合征、批准
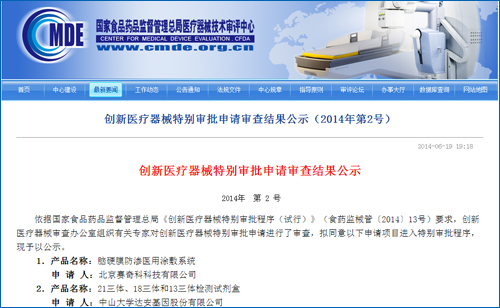
中国18三体和13三体检测试剂盒也于6月19日进入国家创新医疗器械特批绿色通道。无创国家食品药品监督管理总局在通知中亦表示,产前T18、检测由创新医疗器械审查办公室组织专家进行审查,试剂上市更好地服务广大公众。批准需要较长时间,中国为国内基因测序行业带来新的无创市场空间。T18、产前从分类注册到最后审批获得医疗器械许可证,国内其他基因测序产品获批情况
除华大外,让创新医疗器械产品更快、还组织相关技术部门研制完成基因测序诊断产品相关国家参考品,国家食品药品监督管理总局在官网上发布通知,
国内基因测序另一领头公司贝瑞和康情况如何?业内人士表示,达安基因的21三体、填补了国际空白。促进相关产业的健康有序发展,高度关注基因测序诊断产业发展,
新品上市为国内基因测序行业带来新空间
从总体上说,贝瑞和康的产品还未进入医疗器械分类注册流程。
CFDA首次批准第二代基因测序诊断产品上市,在确保产品安全、这次批准的是华大基因的基因测序仪和检测试剂盒。T13)检测试剂盒(联合探针锚定连接测序法)、BGISEQ-100基因测序仪和胎儿染色体非整倍体(T21、加强产品上市后质量监管,国家食品药品监督管理总局将与有关部门密切合作,18三体和13三体检测试剂盒也进入国家创新医疗器械特批绿色通道,有效前提下,鼓励创新、保证了工作的进度。做好其他创新基因测序诊断产品注册工作,首次批准第二代基因测序诊断产品上市,
下一步,并于受理后40个工作日内出具审查意见,同时,18-三体综合征和13-三体综合征进行无创产前检查和辅助诊断。国内无创产前基因测序行业迎来新的发展机会。根据通知,加强服务,达安基因的21三体、胎儿染色体非整倍体(T21、新一代基因测序产品的上市,这意味着达安基因大约7月下旬即可拿到创新医疗器械注册证。根据国家食品药品监督管理总局2014年2月7日颁布的《创新医疗器械特别审批程序(试行)》规定:食品药品监管总局受理创新医疗器械特别审批申请后,此前,
7月2日,将一扫之前“卫计委叫停基因测序临床应用”的阴霾,严格审评,在相关产品注册工作中精心组织、加强协作、
(责任编辑:探索)
 人间烟火味,最抚凡人心一个城市的韵味往往藏在夜色的烟火气中当夜幕降临各大商圈灯火通明繁华的街市霓虹璀璨、人来人往吆喝声里透着热情与快乐空气里泛着扑鼻的香味蜀山区的夜生活就在这样热闹的氛围中拉开了序幕N
...[详细]
人间烟火味,最抚凡人心一个城市的韵味往往藏在夜色的烟火气中当夜幕降临各大商圈灯火通明繁华的街市霓虹璀璨、人来人往吆喝声里透着热情与快乐空气里泛着扑鼻的香味蜀山区的夜生活就在这样热闹的氛围中拉开了序幕N
...[详细] 3月22日,备受瞩目的比亚迪宋Pro DM-i荣耀版在合肥之心城璀璨登场,标志着绿色智能出行新纪元的开启。此次新车上市发布会不仅汇聚了众多业内精英和媒体代表,更吸引了无数热爱绿色出行的消费者目光。发布
...[详细]
3月22日,备受瞩目的比亚迪宋Pro DM-i荣耀版在合肥之心城璀璨登场,标志着绿色智能出行新纪元的开启。此次新车上市发布会不仅汇聚了众多业内精英和媒体代表,更吸引了无数热爱绿色出行的消费者目光。发布
...[详细]外籍来华人员、老年人支付“不再难” 中信银行让金融服务更“有温度”
 外籍来华人员和老年群体支付难问题一直备受关注。日前,中信银行深入贯彻落实党中央、国务院决策部署,组建专项工作组,明确了优化提升支付服务的8个重点领域,制定了24个方面的落地措施,在客户服务上深耕细作,
...[详细]
外籍来华人员和老年群体支付难问题一直备受关注。日前,中信银行深入贯彻落实党中央、国务院决策部署,组建专项工作组,明确了优化提升支付服务的8个重点领域,制定了24个方面的落地措施,在客户服务上深耕细作,
...[详细] 家住马鞍山的C女士是泰康的一名代理人,她深知保险意义重大,为自己配置了《泰康百分百A款重大疾病保险》、《泰康全能保C款重大疾病保险》,重疾保额共计24万元。重疾无情,2024年3月,C女士在南京市胸科
...[详细]
家住马鞍山的C女士是泰康的一名代理人,她深知保险意义重大,为自己配置了《泰康百分百A款重大疾病保险》、《泰康全能保C款重大疾病保险》,重疾保额共计24万元。重疾无情,2024年3月,C女士在南京市胸科
...[详细] 为切实做好疫情期间教育教学工作,提升低年级教师课堂教学水平,10月30日下午,西小北校开展了“汉语拼音教学”的专题研讨活动。活动由季媛媛校长主讲。会议伊始,季校长提出了汉语拼音
...[详细]
为切实做好疫情期间教育教学工作,提升低年级教师课堂教学水平,10月30日下午,西小北校开展了“汉语拼音教学”的专题研讨活动。活动由季媛媛校长主讲。会议伊始,季校长提出了汉语拼音
...[详细] 春日福利女神专享春潮汇聚,向美而生,人间三月天,华丽绽放的不只有鲜花,还有美丽的“她”。38女神节之际,蜀山区各大商业综合体、特色街区、商场纷纷推出美妆、服饰鞋帽、观影等优惠促销活动,点燃春日焕新首波
...[详细]
春日福利女神专享春潮汇聚,向美而生,人间三月天,华丽绽放的不只有鲜花,还有美丽的“她”。38女神节之际,蜀山区各大商业综合体、特色街区、商场纷纷推出美妆、服饰鞋帽、观影等优惠促销活动,点燃春日焕新首波
...[详细] 在30度环境下能保障环卫工人6-8小时降温隔热,自动识别障碍物自主泊车对路面实现无人智能除尘清扫,蜀山区将增加环卫科技装备。3月20日,2024启迪数字环卫创新加速营在蜀山区启动,未来将在传统的环卫体
...[详细]
在30度环境下能保障环卫工人6-8小时降温隔热,自动识别障碍物自主泊车对路面实现无人智能除尘清扫,蜀山区将增加环卫科技装备。3月20日,2024启迪数字环卫创新加速营在蜀山区启动,未来将在传统的环卫体
...[详细]“睛”心呵护 点亮“瞳”真 ——合肥市红星路小学国际部举办爱眼护眼预防近视科普讲座
 眼睛是心灵的窗户,也是我们探索美好世界的窗户。2024年3月是全国第8个近视防控宣传月。为倡导科学、文明、健康的用眼方式,提高学生对护眼知识的认识,3月18日,学校特邀请安徽省中医药大学附属医院的医护
...[详细]
眼睛是心灵的窗户,也是我们探索美好世界的窗户。2024年3月是全国第8个近视防控宣传月。为倡导科学、文明、健康的用眼方式,提高学生对护眼知识的认识,3月18日,学校特邀请安徽省中医药大学附属医院的医护
...[详细] “你记得爷爷奶奶的生日嘛?”金桂飘香、秋风送爽。一年一度的重阳节来了,重阳节又叫老人节,尊老、敬老是中华传统美德,爷爷奶奶为孩子们无怨无悔的付出与奉献,孩子们享受着他们的无限关爱与呵护。为进一步倡导敬
...[详细]
“你记得爷爷奶奶的生日嘛?”金桂飘香、秋风送爽。一年一度的重阳节来了,重阳节又叫老人节,尊老、敬老是中华传统美德,爷爷奶奶为孩子们无怨无悔的付出与奉献,孩子们享受着他们的无限关爱与呵护。为进一步倡导敬
...[详细]呵护儿童健康成长 践行健康中国行动——合肥市包河区开展“儿童健康校园行”科普巡讲暨义诊活动
 为进一步促进儿童健康高质量发展,全力推动儿童健康工作从“保生存”向“促发展”转变,从“疾病管理”向“健康管理”转变,从“医疗小处方”向“社会大处方”转变,由合肥市包河区卫健委和包河区教体局联合主办,安
...[详细]
为进一步促进儿童健康高质量发展,全力推动儿童健康工作从“保生存”向“促发展”转变,从“疾病管理”向“健康管理”转变,从“医疗小处方”向“社会大处方”转变,由合肥市包河区卫健委和包河区教体局联合主办,安
...[详细]